As doenças periodontais são processos infecciosos multifatoriais causados por complexos de micro-organismos, que provocam danos à saúde, produção e ao bem-estar animal. O objetivo do presente estudo foi o de avaliar a eficácia da virginiamicina na prevenção e controle de duas formas de doença periodontal; a gengivite e a gengivite necrosante. Assim, dez bezerros desmamados, com idade entre 4 e 6 meses, foram mantidos permanentemente em lote único e sob o mesmo regime de pastejo rotacionado em área reformada de Panicum maximum. Cinco bezerros receberam via oral 340mg de virginiamicina (Grupo Virginiamicina) diariamente, por um período de dezoito semanas, enquanto o Grupo Controle permaneceu sob o mesmo manejo alimentar, mas sem receber a virginiamicina. No período, os animais passaram por 18 avaliações semanais quanto à saúde periodontal, com monitoramento e registro dos parâmetros clínicos dos oito dentes incisivos decíduos, nas suas faces labial e lingual.
Em intervalos aproximadamente quinzenais foram realizadas nove coletas de material do sulco subgengival de cinco sítios de quatro dentes incisivos direitos de cada animal para avaliação microbiológica, com o emprego da reação em cadeia da polimerase e com iniciadores de 25 micro-organismos considerados potencialmente patogênicos. Ao final das 1440 avaliações clínicas periodontais dos dentes incisivos dos dez bezerros, pôde-se registrar um total de 395 episódios de dentes com gengivite, nos quais 267 foram registrados no Grupo Controle e 128 no Grupo Virginiamicina. De forma semelhante, do total de 89 registros de gengivite necrosante, 58 foram no Grupo Controle e 31 no Grupo Virginiamicina. Na comparação entre médias dos grupos as diferenças encontradas para dentes com gengivite e gengivite necrosante foram significativas pelo teste t (p<0,05). Assim, o total de dentes com gengivite (p<0,01) e gengivite necrosante (p<0,01) no Grupo Controle, foi significativamente superior ao de gengivite (p<0,01) e gengivite necrosante (p<0,05) do Grupo Virginiamicina. Houve correlação positiva entre o total de ocorrência de gengivite e gengivite necrosante no Grupo Virginiamicina pelo teste de Pearson. A virginiamicina possuiu um efeito protetor nos animais tratados em comparação com o controle (OR = 0,36: IC (95%) = 0,27-0,43). Na avaliação microbiológica do Grupo Controle foram detectados nas amostras de sítios sadios, com gengivite ou com gengivite necrosante Actinomyces israelli (4,74%), domínio Archaea (1,58%), Eikenella corrodens (1,05%), Fusobacterium nucleatum (27,37%), classe Mollicutes (5,26%), Porphyromonas endodontalis (5,26%), Porphyromonas gulae (0,53%), Prevotella buccae (6,32%), Prevotella loescheii (3,68%), Prevotella nigrescens (8,42%), Prevotella oralis (1,58%), Tannerella forsythia (0,53%) e Treponema denticola (4,21%).
Enquanto no Grupo Virginiamicina foram detectados: A. israelli (3,41%), domínio Archaea (0,98%), F. nucleatum (9,27%), classe Mollicutes (4,39%), P. endodontalis (4,39%), P. gulae (0,49%), P. buccae (8,29%), P. loescheii (6,83%), P. nigrescens (15,61%), P. oralis (1,46%), Selenomonas sputigena (0,49%), T. forsythia (0,49%) e T. denticola (2,44%). Em conclusão, a virginiamicina administrada na dosagem de 340mg/animal/dia reduziu significativamente a ocorrência da gengivite e gengivite necrosante em bovinos mantidos em pastos reformados e revelou ter ação frente à microbiota bacteriana periodontal considerada potencialmente patogênica.
INTRODUÇÃO
As doenças periodontais são um grupo de doenças que afetam os tecidos associados à proteção e suporte dos dentes. Entre as formas reversíveis de doença periodontal estão a gengivite e a gengivite necrosante, que são causadas predominantemente pela agressão do biofilme gengival (Konradsson et al., 2007; Kistler et al., 2013).
A gengivite não tratada pode progredir para a periodontite, com consequente comprometimento dos ligamentos periodontais e osso alveolar, culminando na perda dentária (Page, 1986; Lyon, 2005; Kinane e Bartold, 2007; Herrera et al., 2014). Dessa forma, a saúde do periodonto depende do equilíbrio entre a composição bacteriana do biofilme dental e sua interação com o sistema imunológico do hospedeiro (Hajishengallis, 2015).
Em bovinos, a gengivite tem sido relatada em bezerros com idade entre 5 e 60 dias, caracterizada como uma manifestação fisiológica resultante da erupção dos dentes (Döbereiner et al., 1974). Além disso, a gengivite necrosante foi descrita em bovinos com deficiência de adesão leucocitária (Nagahata et al., 1993). No entanto, nesta espécie animal, pouco se sabe sobre as doenças gengivais, provavelmente devido às dificuldades na avaliação da cavidade oral dos animais e ao fato de que essas doenças não apresentam mudanças clínicas evidentes como vista na periodontite. No entanto, em humanos e adolescentes, essas doenças têm sido bem descritas (Kiran et al., 2011; Marshall et al., 2014).
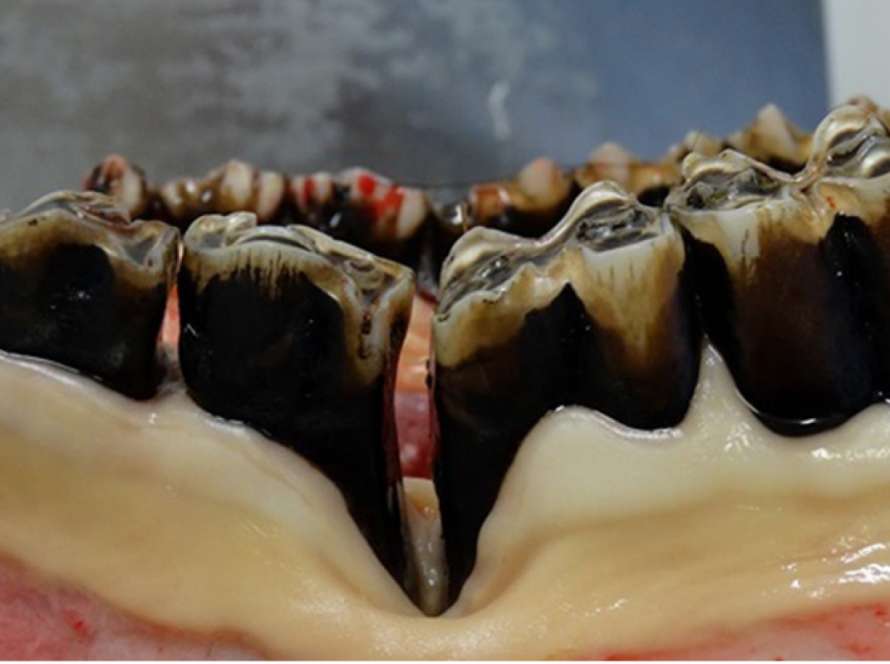
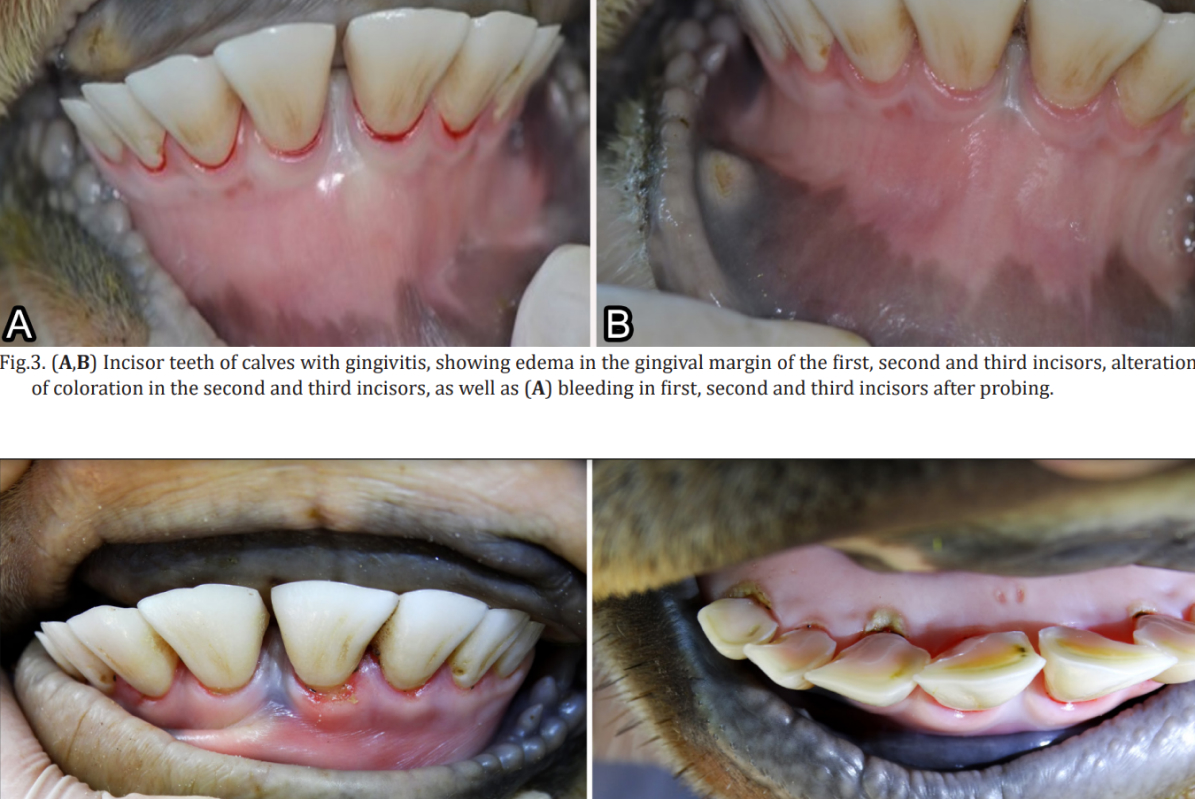
Em casos de gengivite, observa-se que a borda gengival é intensamente vermelha e edematosa, e o sangramento, seja espontâneo ou ao sondar, pode ser observado, e em casos mais graves, a gengiva pode apresentar úlceras (Diehl e Rosychuk, 1993; Lyon, 2005; Riggio et al., 2011; Newman et al., 2012; Antiabong et al., 2013; Kutasi et al., 2016). Em casos de gengivite necrosante, pode-se observar sangramento espontâneo ou sangramento após sondagem, bem como a presença de uma camada de fibrina amarelada-branca ou cinza-branca na borda gengival necrótica (Klokkevold, 2012; Rodríguez-Pulido et al., 2016).
As doenças periodontais ocorrem pela modificação da microbiota e constituintes da cavidade oral; em humanos, vários fatores modificadores têm sido associados à ocorrência de gengivite e gengivite necrosante, incluindo mudanças hormonais e imunodeficiências (Stamm, 1986; Rowland, 1999; Dufty et al., 2016). No entanto, em bovinos, os fatores modificadores associados à ocorrência de doenças periodontais são desconhecidos e as suspeitas estão relacionadas ao manejo do solo e à dieta (Dutra et al., 1993; Döbereiner et al., 2000).
Em um estudo recente, os microbiomas orais de bovinos saudáveis e aqueles com periodontite revelaram uma dissimilaridade de 72,1%; no entanto, a diversidade de bactérias encontradas em locais saudáveis e doentes foi semelhante, com uma predominância dos gêneros Prevotella, Fusobacterium e Porphyromonas em lesões periodontais (Borsanelli et al., 2018). Assim, pode-se evidenciar que a microbiota oral bovina é rica e diversificada, composta por 395 gêneros ou táxons superiores e que os microrganismos considerados como patógenos periodontais potenciais estão associados à ocorrência de periodontite nesses animais. Estes incluem várias espécies de Porphyromonas, Prevotella e Treponema, bem como Fusobacterium nucleatum, Fusobacterium necrophorum e Actinomyces naeslundii (Dutra et al., 2000; Borsanelli et al., 2015a, 2015b; Borsanelli, 2017).
Em estudos anteriores, a virginiamicina demonstrou ser eficiente para a recuperação de bezerros com periodontite (Tims et al., 1992), bem como para a prevenção da periodontite (Dutra et al., 1993). Nesse contexto, o presente estudo teve como objetivo avaliar a eficácia da vir
giniamicina para o controle da gengivite e gengivite necrosante em bovinos, tendo em vista a necessidade de desenvolver estratégias para o controle de doenças periodontais em animais de produção e características do antibiótico.
MATERIAIS E MÉTODOS
Animais. Dez bezerros machos da raça Jersey ou mestiços, desmamados e saudáveis, com idade entre quatro e seis meses, foram utilizados. Eles foram pesados e randomizados em dois grupos de cinco animais cada. Os animais permaneceram sob pastejo rotativo e mesmo manejo zootécnico em 24 piquetes (aproximadamente 3 hectares) que haviam sido previamente reformados para simular a situação representativa potencial para a ocorrência de doença periodontal em bovinos. Pastagens mistas de capim Massai (Panicum maximum cv. Massai) e Mombaça (Panicum maximum cv. Mombaça) foram reformadas seguindo práticas agrícolas convencionais, como análise do solo, calagem e adubação. Água e sal mineral foram fornecidos ad libitum ao longo do período total de aproximadamente 24 semanas de experimentação, incluindo a adaptação dos animais à dieta. Cinco animais (Grupo Virginiamicina) receberam administração oral diária de virginiamicina (340mg/dia/animal) por 18 semanas consecutivas, enquanto os outros cinco (Grupo Controle) não receberam o antibiótico.
Avaliação clínica geral e periodontal. No início do experimento, os animais apresentavam boa condição corporal para sua idade e estavam aparentemente saudáveis. No exame clínico oral inicial, eles tinham dentição decídua, com unidades dentárias (dente e periodonto) normais. A avaliação clínica periodontal semanal dos dentes incisivos foi realizada por 18 semanas consecutivas, iniciando-se após quatro semanas de adaptação à dieta e ao manejo e coincidindo com a administração de virginiamicina. Para o exame, os bezerros foram contidos fisicamente no tronco, e o estado periodontal foi avaliado com auxílio de um abridor de boca e lanterna e registrado em odontogramas individuais. Embora a condição clínica visível do arco dentário dos animais tenha sido examinada, apenas as faces lingual e labial dos dentes incisivos foram avaliadas no presente estudo, evitando qualquer meio de contenção química que pudesse interferir no objetivo da pesquisa. Os critérios para o exame clínico periodontal foram baseados nos utilizados por Löe (1967). A gengivite foi caracterizada pela presença de edema na borda gengival, aparência, cor, sangramento espontâneo ou sangramento associado à sondagem. Para casos de gengivite necrosante, buscou-se visualizar a presença de úlceras na margem gengival, com ou sem a presença de um pseudomembrana branca-acinzentada/amarelada e dor à manipulação.
Coleta de material para exames microbiológicos. Amostras foram coletadas a cada duas semanas ao longo do estudo. Após remoção de resíduos alimentares, secagem da saliva e remoção do biofilme supragengival com gaze estéril, o biofilme foi coletado do sulco gengival de quatro incisivos, dos seguintes dentes: 401 na face labial e lingual, 402, 403 e 404. Materiais de curetagem (cureta Gracey) ou cone de papel foram embalados em tubos criogênicos com água ultrapura e armazenados a -80°C até a extração de DNA.
Extração de DNA microbiano. Cada amostra para detecção de DNA bacteriano em água ultrapura estéril foi extraída por fervura. Primeiro, a amostra foi homogeneizada por 20 segundos; foram então retirados alíquotas de 500μl e armazenados em tubos Eppendorf. As amostras foram então fervidas por 15 minutos, centrifugadas a 10.36×g por 5 minutos e alíquotas de 400μl. As amostras foram então armazenadas a -80°C até que a reação de amplificação do DNA fosse realizada pela reação em cadeia da polimerase (PCR).